关于贝迪
贝迪生物2003年8月创建于无锡马山生物医药工业园,是一家专业从事医用生物活性胶原蛋白原料及胶原基组织工程医疗产品研发生产的高新技术企业。
了解更多

在骨科手术中,骨缺损修复一直是一个挑战。传统的自体骨移植虽然效果显著,但存在供体部位并发症、疼痛和感染等风险。近年来,随着再生医学的发展,医用胶原蛋白海绵作为一种生物支架材料,结合干细胞技术,为骨缺损修复带来了新的希望。
01
研究目的
本研究的主要目的是评估外周血细胞来源的iPSC的成骨能力,并验证其在骨缺损修复中的潜力。具体目标包括:
1. 从外周血MNC中构建iPSC。
2. 将iPSC分化为成骨细胞,并评估其功能。
3. 利用胶原蛋白海绵作为支架将成骨细胞移植到大鼠颅骨缺损模型中,观察骨再生效果。
02
研究方法

1
iPSC的构建与验证
细胞来源:从健康受试者的外周血中提取MNC,并选择性分离T细胞。
重编程:使用仙台病毒载体(携带OCT3/4、SOX2、KLF4和c-MYC基因)将T细胞重编程为iPSC。
验证:通过未分化标志物(如SOX2、OCT3/4)的表达和畸胎瘤形成试验(验证其多能性)确认iPSC的成功构建。

2
成骨细胞的分化与评估
分化过程:将iPSC通过胚状体(EB)形成和贴壁培养分化为成骨细胞,使用成骨细胞培养基(含抗坏血酸、β-甘油磷酸盐和地塞米松)。
标志物检测:通过qPCR检测成骨细胞标志物(COL1A1、ALP、RUNX2)的表达,确认分化成功。

3
体内骨再生实验
动物模型:在大鼠颅骨上制造临界尺寸骨缺损(直径5毫米)。
移植:将iPSC来源的成骨细胞与胶原海绵支架复合后移植到骨缺损处。
评估:术后4周通过微型CT和组织学分析(H-E染色和Masson三色染色)评估新骨形成情况。
03
研究成果
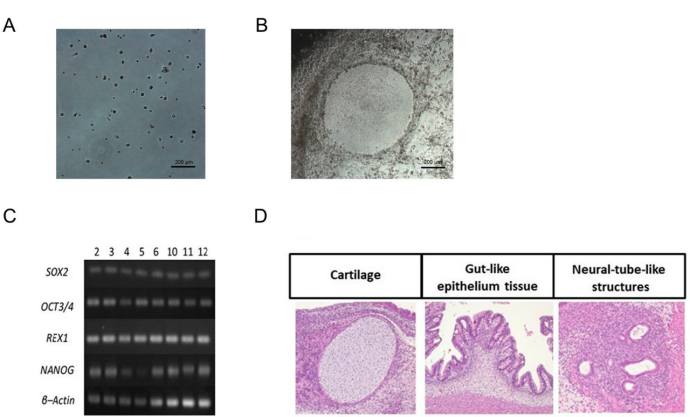
iPSC构建成功
仙台病毒转染后约20天出现胚胎干细胞样克隆,且表达未分化标志物(SOX2、OCT3/4等)。
畸胎瘤试验证实iPSC具有多能性,可分化为三个胚层的组织(如软骨、肠样上皮和神经管样结构)。
成骨细胞分化
iPSC在成骨细胞培养基中培养14天后,成骨标志物(COL1A1、ALP、RUNX2)表达显著上调,表明成功分化为功能性成骨细胞。
体内骨再生效果
微型CT显示,移植组的骨缺损区域有新骨形成,且分布广泛(不仅限于边缘)。
组织学分析表明,新生骨具有层状结构和骨细胞,功能成熟,且未观察到肿瘤形成。
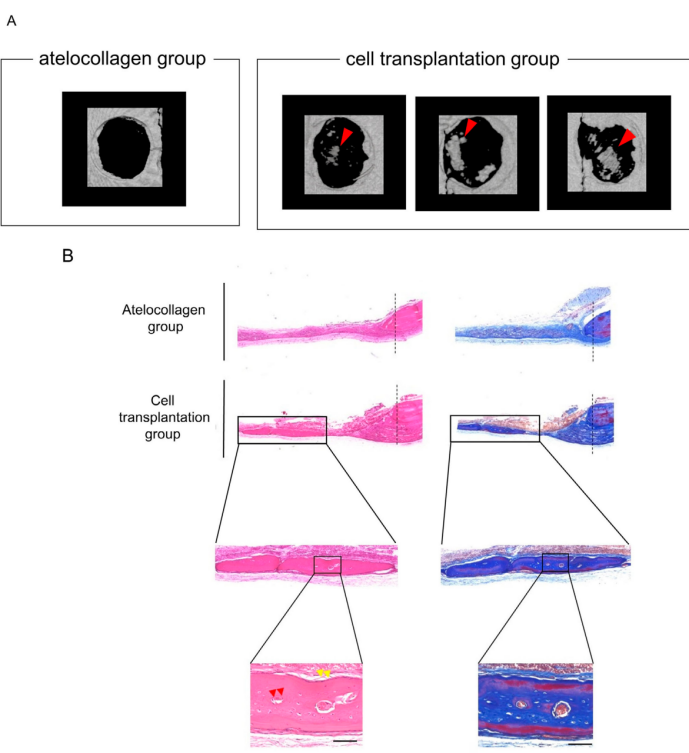
术后4周,观察到新生骨形成。
04 胶原蛋白海绵
医用胶原蛋白海绵因其独特的生物学优势成为骨组织工程中的热门材料。
三维多孔结构

为细胞提供附着和生长的空间,促进营养和氧气的传输。支架结构引导细胞有序生长,促进骨缺损的快速修复。
生物相容性

避免免疫排斥反应,支持细胞增殖和分化。
可降解性

随着新骨的形成逐渐降解,最终被人体自然吸收。



本研究成功从外周血MNC中构建了iPSC,并证实其可分化为功能性成骨细胞。通过胶原海绵支架移植,这些细胞在大鼠颅骨缺损模型中表现出显著的骨再生能力。
随着iPSC技术和胶原蛋白海绵材料的不断进步,未来骨缺损患者或将迎来更安全、更高效的治疗选择。
参考文献:
Hiroshi KATO, et al. Bone regeneration of inducedpluripotent stem cells derived fromperipheral blood cells in collagensponge scaffolds[J].J Appl Oral Sci,2022,30:e20210491.
